以机油为分散剂高温热解人发合成新型碳点及其生物效应研究

摘要:目的 以机油为分散剂高温热解人发后发现新型纳米碳点,通过动物实验评价了该碳点的生物效应。方法 利用高温热解法对人发和机油进行炭化,对炭化产物进行萃取、过滤分离和透析得到一种具有水溶性的新型物质碳点,并命名为JYRF-CDs。利用透射电子显微镜(TEM)、高分辨透射电子显微镜(HR-TEM)、紫外-可见分光光谱、傅里叶变换红外光谱、荧光光谱、X射线光电子能谱分析(XPS)等多种方法对JYRF-CDs进行表征,利用小鼠单核巨噬细胞RAW264.7细胞进行CCK-8毒性实验来评价JYRF-CDs的安全性,并通过小鼠耳肿胀实验和小鼠醋酸扭体实验对JYRF-CDs的生物效应进行评价。结果JYRF-CDs外形为类球形,粒径均匀分布在1.8~3.6 nm,晶格间距为0.219 7 nm。细胞毒性实验结果显示,JYRF-CDs具有低毒性,动物实验结果表明JYRF-CDs具有良好的抗炎和镇痛作用。结论首次以机油为分散剂高温热解人发后发现一种全新的碳点JYRF-CDs,以JYRF-CDs为突破口,更加明确阐释以机油为分散剂高温热解人发后炭化产物具有生物效应的物质基础,为纳米类成分的研究提供了一种新方法。
血余炭,始载于《五十二病方》[1],是人发高温炭化后的产物,具有收敛止血、化瘀、利尿的功效,主要用于吐血、咯血、衄血、血淋、尿血、便血、崩漏、外伤出血、小便不利等。血余炭已有2 000多年的应用历史,现已被收入到国家药品标准《中国药典》2020年版中。
《金匮要略》[2]中记载:“诸黄,猪膏发煎主之。”可见古籍中就早有猪膏与人发合煎的记载,但是受限于古代的生产水平,并没有更好的分散剂作为选择。机油虽不能食用,但本身含碳量高,高温环境下更有利于碳点的合成,本研究就是以机油为分散剂高温热解人发来进行血余炭的研究。血余炭的功效与其炮制加工过程密不可分,现代医学实验[3-4]也已经证明了通过高温炭化的方法能赋予许多中药抗炎镇痛的效果。但是,高温炭化后的药效物质基础并没有一个标准化的研究。
碳点作为一种新兴的纳米材料,是直径通常为1~10 nm类球型纳米颗粒。与传统的半导体量子点相比,碳点具有高水溶性、易功能化、耐光漂白、低毒、性能优良等优点[5-7]。它们广泛应用于生物医学领域,如药物递送[8]、生物成像[9]、癌症治疗[10]。特别是纳米药物在疾病治疗中的应用吸引了相当多的关注,显示出巨大的临床应用潜力。近年来,众多学者也已经对碳点的合成、性质及其应用进行了广泛的研究[11]。然而,碳点的内在生物活性和潜在药理作用尚未引起人们足够的重视,这一科学领域的研究也是十分必要的。
本研究中,以机油为分散剂高温热解人发后发现并分离出了碳点,利用低分辨透射电镜(TEM)与高分辨透射电镜(HR-TEM)获取其形态大小、粒径分布及晶格间距等特征;利用紫外光谱(UV- Vis)与荧光光谱(FL)等光学方法来分析该量子点的光学特征;利用红外光谱(FTIR)来解析该碳点的表面化学基团信息;利用X射线光电子能谱(XPS)分析获得碳量子点所含元素和原子连接方式。利用这些方法充分表征了新型纳米碳点,并最终确定以机油为分散剂高温热解人发后存在碳量子点,将其命名为JYRF-CDs。利用CCK-8细胞毒性实验来探索JYRF-CDs的安全性,并利用小鼠耳肿胀模型和小鼠醋酸扭体模型评价其生物效应。
1 仪器与材料
1.1 仪器
PXR-9马弗炉,北京中科澳博科技股份有限公司;TecnaiG220透射电子显微镜,美国FEI公司;JEN-1230高分辨透射电子显微镜,日本Electron OpticsLaboratory Co., Ltd.;CECIL紫外分光光度计,英国Cambridge公司;F-4500荧光分光光度计,日本Hitachi公司;Escalab 250Xi X射线光电子能谱分析仪,美国Thermo FisherScientific公司;D8-AdvancedX射线衍射仪,德国BrukerAXS公司。
1.2 药品和试剂
机油购买于北京中科旭龙润滑油技术有限公司;阿司匹林肠溶片,规格100 mg/片,批号J20130078,购于东北制药集团沈阳第一制药有限公司;人发购于北京中医药大学理发店;二甲苯购于北京虹湖联合化工产品有限公司;相对分子质量1000透析膜购于北京瑞达恒辉科技发展有限公司;戊巴比妥钠,规格50 mg/片,批号P3761,购于美国Sigma公司;乙醇和其他分析级化学试剂均购于北京化学试剂公司。所有实验用水均为去离子水。
1.3 动物
本实验所有小鼠购于北京金牧阳实验动物养殖有限责任公司,质量合格证编号为1103221911017504。SPF级雄性昆明小鼠40只,体质量(30.0±2.0)g。实验环境为北京中医药大学西校区动物房屏障系统,保持室温(24.0±1.0)℃,相对湿度55%~65%,12 h明暗交替,通风良好,饲养期间内自由进水、进食,实验前12 h小鼠禁食不禁水。
2 方法
2.1 JYRF-CDs的制备
首先将50 g机油与6.5 g洗净人发放入坩埚中,铝箔纸密封并加盖于马弗炉中烧制。马弗炉程序升温:第一阶段5 min升温至70 ℃,保持30 min;第二阶段25 min升温至350 ℃,保持1 h。在冷却到室温后用1 000 mL去离子水对炭化产物进行萃取,重复3次。用滤纸粗过滤残渣,再使用0.22 μm的微孔滤膜过滤残渣,合并3次滤液,浓缩滤液。将浓缩液透析7 d,所用透析膜相对分子质量1 000,透析液为去离子水。将获取的JYRF-CDs于4 ℃保存,留置待用。
2.2 JYRF-CDs的表征
利用TEM观察JYRF-CDs的形貌、粒径分布和微观结构特征;利用HR-TEM观察其晶格间距等内部结构详细特征。利用紫外分光光度计和荧光分光光度计分析JYRF-CDs的光学特征和结构特征;利用红外分光光度计分析JYRF-CDs表面的官能团信息。利用X射线光电子能谱分析仪分析JYRF- CDs中所含有元素及其可能连接方式。利用X射线衍射仪(XRD)分析并获取JYRF-CDs的晶格间距信息。
2.3 荧光量子产率(fluorescence quantum yield,FQY)
荧光物质经过吸光后发射荧光的光子数与其所吸收的激发光光子数的比值即为FQY[12]。本实验中测定的结果为JYRF-CDs的相对FQY,参比物质选择硫酸奎宁[13]。荧光光谱扫描时激发波长(λx)与发射波长(λm)的狭缝宽度皆为10 nm。根据以下公式FQYCDs=FQYRICDsARηCDs2/(IRACDsηR2)对JYRF-CDs的FQY进行计算,公式中“I”为发射光谱下的峰面积,“A”为365 nm时的吸收值,“η”为溶剂的折射率,下标“CDs”和“R”代表JYRF-CDs和标准品。为了使重吸收效应最小化,AR和ACDs应该保证在0.05以下。
2.4 细胞毒性测定
安全性是临床应用首先要考虑的因素之一,由于药物毒性多与诱发机体炎症、氧化应激等相关,机体中的巨噬细胞在免疫炎症反应的各种过程皆发挥着重要作用,是目前评判药物毒性常用的细胞株之一[14-15]。本实验将利用小鼠单核巨噬细胞(RAW264.7)进行CCK-8细胞毒性试验,评价JYRF-CDs的细胞毒性。将培养良好的RAW264.7细胞悬液稀释至1×105细胞/mL,置于96孔板上。四周加入磷酸盐缓冲液(PBS),置于CO2培养箱(37 ℃、5% CO2)中孵育24 h,弃去96孔板中的上清液。对照组中加入DMEM,给药组分别加入配制的不同质量浓度的JYRF-CDs溶液(1 000、500、250、125、62.5 μg/mL),每孔100 μL,置于CO2培养箱中孵育24 h。加入CCK-8试剂(10 μL/孔)再放入CO2培养箱中培养3 h后取出。使用酶标仪读取吸光度(A)值,检测波长为450 nm。所得数据按公式计算细胞存活率。
细胞存活率=(Ae-Ab)/(Ac-Ab)
Ae、Ac、Ab分别表示给药组、对照组、空白组在450 nm处的A值
JYRF-CDs倍比稀释液的配制:以DMEM作为溶剂加入到JYRF-CDs粉末中,于涡旋混合器上震荡使粉末完全溶解,最终配制成1 mg/mL的JYRF-CDs溶液,将该溶液用0.22 μm的微孔滤膜滤过后作为母液。以DMEM为溶剂将母液以2倍浓度倍比稀释得到6个质量浓度的溶液,备用。
2.5 动物实验
2.5.1 药品配制
(1)样品的制备:JYRF-CDs溶液精密称取JYRF-CDs粉末,加入去离子水制备成质量浓度为240 mg/mL的JYRF-CDs溶液,备用。
(2)阳性药的配制:取阿司匹林肠溶片粉末72 mg,加入6 mL去离子水,震荡摇匀,使其完全溶解,制得质量浓度为12 mg/mL的阳性药溶液,避光保存,备用。
(3)麻醉剂:精密称量4.0 g水合氯醛粉末,倒入磨口具塞三角瓶中,加入100 mL去离子水配制成4%的水合氯醛溶液,震荡使完全溶解,备用。
2.5.2 小鼠耳肿胀实验[16] 本实验分组分别为对照组、阳性药(阿司匹林肠溶片)组及JYRF-CDs高、中、低剂量给药组,共5组。昆明雄性小鼠,体质量(30.0±2.0)g,共40只,每组8只,通过ig给药方式进行实验。阳性药给药剂量为200 mg/kg;给药组的高、中、低剂量分别为120、60、30 mg/kg。对照组给予生理盐水溶液20 mL/kg。连续给药3 d,第3天给药2 h后,在小鼠右耳上涂抹二甲苯,剂量为20 μL。涂抹二甲苯40 min后,用打孔器在左右耳同一位置剪取一部分,分别称取质量,并统计得到结果,肿胀度为右耳和左耳的质量差。耳肿胀率计算公式为耳肿胀率=(左耳部分质量-右耳部分质量)/右耳部分质量。
2.5.3 小鼠醋酸扭体实验[17] 本实验分组分别为对照组、阳性药(阿司匹林肠溶片)组及JYRF-CDs高、中、低剂量给药组,共5组。昆明雄性小鼠SPF级,体质(30.0±2.0)g,共40只,每组8只,通过ig给药方式进行实验。阳性药给药剂量为200 mg/kg;给药组(已配好)的高、中、低剂量分别为120、60、30 mg/kg;上述5组分别给药0.5 mL。对照组给予生理盐水溶液20mL/kg。连续给药3 d,第3天给药2 h后,小鼠ip 0.7%冰醋酸,剂量为0.01 mL/g,给完冰醋酸后立即计时15 min,通过观察小鼠15 min内扭体次数,记录数据,并分析得到结果。
2.6 统计方法
采用SPSS 25.0统计软件,数据以表示,统计学处理采用方差分析。单因素ANOVA分析方法用于实验数据服从正态分布,同时方差齐。组间差异则运用LSD方法统计。
3 结果
3.1 JYRF-CDs制备和表征结果
JYRF-CDs溶液通过高温炭化、萃取分离、过滤、浓缩、透析等一系列步骤制备完成。
利用透射电镜观察JYRF-CDs的形态大小和微观结构,TEM观察结果(图1-a)表明机油与人发炭化产物中的纳米类成分粒径分布(图1-b)在1.8~3.6 nm,分布均一,主要集中在2.5nm左右;图中可以看出纳米类成分分布符合正态分布特征,JYRF-CDs的粒径具有良好均一性。HR-TEM结果见图1-d,JYRF-CDs粒径形状为类球形结构,晶格大小分布清晰可见,晶格间距为0.219 7nm。利用X射线衍射仪分析JYRF-CDs内部原子在空间分布的状态。JYRF-CDs的XRD谱图(图1-c)显示JYRF-CDs的衍射角度2θ=21.665°,可以观察出衍射峰,据此可推测出JYRF-CDs是由高度无定形的碳结构所构成的[18]。经文献查阅,其对应的晶格间距约为0.2156 nm,与HR-TEM的测试结果基本吻合。
JYRF-CDs的紫外光谱图(图1-e)表明该量子点在260 nm左右有极其微弱的吸收峰,这可能是由于C=O双键引起的n-π*跃迁所导致。从JYRF-CDs的荧光光谱图(图1-f)中可以看出,该量子点的最大激发波长在365 nm左右,最大发射波长在441 nm左右。以硫酸奎宁作为参照物,计算出JYRF-CDs的量子产率为4.15%。JYRF-CDs的红外光谱(图1-g)显示吸收峰为3 423、2 920、2 831、1 635、1 384、1 033、599 cm−1,其中3 423 cm−1出峰提示-O-H键的存在,2 920、2 831 cm−1可能含有-C-H键,1 635 cm−1的吸收峰提示可能含有-C=O键,1 384 cm−1的强吸收反映出-C-N键,1 033 cm−1处的吸收峰提示可能含有-C-O-C-键。可以得出JYRF-CDs表面含有羟基、羰基和氨基等官能团。
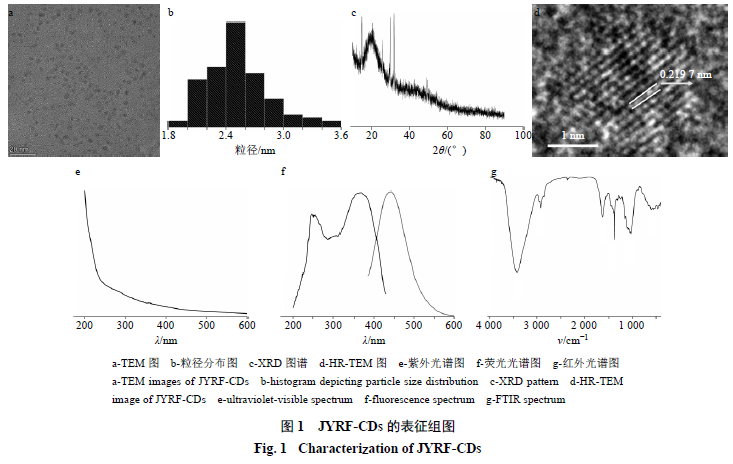
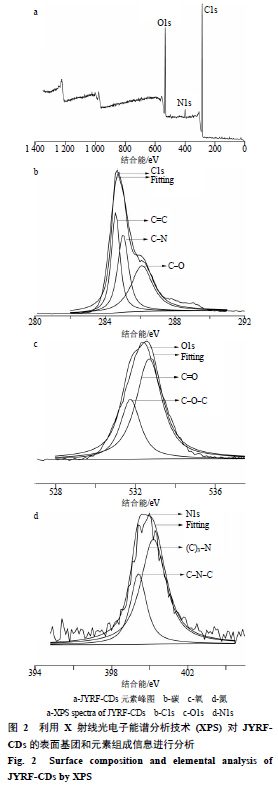
利用X射线光电子能谱来进一步研究JYRF- CDs的元素组成及其配位情况。如图2-a所示,284.78、399.85、532.40 eV处有明显的峰,表明该量子点主要由C(78.9%)、O(16.4%)以及少量的N(4.7%)元素组成。C1s谱带(图2-b)显示284.59、285.02、286.1 eV3个峰,与之对应为C=C、C-N、C-O。O1s谱带(图2-c)显示531.75、532.69 eV2个峰,与之对应为C-O-C、C=O。N1s谱带(图2-d)显示399.40、400.19 eV 2个峰,与之对应为C-N-C、(C)3-N[19-20]。
3.2 细胞毒性实验结果
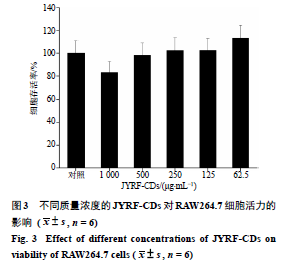
碳点的安全性一直是其生物应用中的一个重要问题。为了对JYRF-CDs的毒性进行研究进而探索其安全性,本实验利用CCK-8实验来检测JYRF- CDs对RAW264.7的细胞毒性。如图3所示,给药质量浓度从62.5~1 000 μg/mL,在给药质量浓度高于500 μg/mL时对细胞有一定的毒性作用,给药质量浓度低于500 μg/mL时对细胞没有明显的毒性,甚至在给药质量浓度为62.5 μg/mL时具有一定的促进增殖的作用。根据以上实验结果,可以看出JYRF- CDs的毒性很低,其安全范围为500 μg/mL。
3.3 药理实验结果
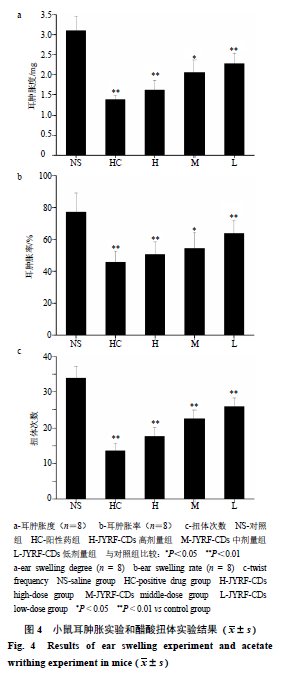
小鼠耳肿胀实验中通过检测耳肿胀度和耳肿胀率来反映抗炎效果,阳性药(阿司匹林肠溶片)和JYRF-CDs高剂量组均可显著抑制二甲苯致小鼠耳肿胀的炎症。从图4-a中可以看出,与对照组比较,阳性药组、高剂量组对耳肿胀具有显著抑制作用,中剂量组和低剂量组也具有一定的疗效,并且差异具有统计学意义(P<0.05、0.01)。从耳肿胀率上(图4-b)分析,与对照组比较,阳性药组、高剂量组、中剂量组具有显著抑制疗效,低剂量组也具有一定的疗效,并且差异具有统计学意义(P<0.05、0.01);小鼠醋酸扭体实验中通过检测扭体次数来反映镇痛效果,阳性药和JYRF-CDs高剂量组均可显著减少小鼠的扭体次数。与对照组比较,阳性药组、高剂量组可显著减少小鼠的扭体次数,中剂量组和低剂量组也一定程度上能够减少小鼠的扭体次数,并且差异具有统计学意义(P<0.01)。这些实验结果表明,JYRF-CDs溶液抑制二甲苯导致小鼠耳肿胀程度,减少小鼠醋酸扭体次数,表现出良好的抗炎镇痛作用,该量子点发挥抗炎镇痛作用的机制也是后期将要重点研究的一个方向。
4 讨论
碳点不含任何重金属,在环保生物应用方面比传统材料更安全[21]。目前,碳点内在的生物活性正逐渐受到人们的关注。Liu等[22]利用水热炭化法从甲硝唑中制备出碳点,并发现这些碳点对Porphyromonas gingivalis具有潜在的选择性抗菌活性。Shi等[23]使用蜡烛烟灰作为碳源制备出碳点并论证其类似过氧化物的活性。虽然碳点的生物活性已经引起了人们的关注,探索新的碳源和具有令人满意的生物活性的碳点仍然具有挑战性。以机油为分散剂高温热解人发制备出的碳点的生物活性研究甚少,这是目前值得研究的优良资源区域。本团队已成功利用荆芥炭[24]、蒲黄炭[25]和荷叶炭[26]等炭药制备出碳点,并证明了这些碳点具有良好的止血效果,并分析了其发挥止血作用的机制。基于这些研究成果,本实验从纳米材料学的角度去分析人发和机油的炭化物发挥生物效应的物质基础。
本实验通过一系列成熟的制备工艺来获取该炭化物纯化后的透析液,经TEM、HR-TEM、FTIR、UV-Vis、FL等仪器鉴定并命名为JYRF-CDs,对其结构进行初步分析,并利用CCK-8细胞毒性实验证明了JYRF-CDs具有低毒性。二甲苯导致小鼠耳肿胀模型和醋酸导致小鼠扭体模型是常用的抗炎镇痛模型,通过动物模型证明了JYRF-CDs在小鼠耳肿胀实验和小鼠醋酸扭体实验中具有很好的抗炎镇痛效果。抗炎镇痛类药物,如阿司匹林与布洛芬等药物,作用于外周而非中枢,其对作用部位更具有选择性,对中枢的副作用较小,毒性较低,对各类炎症性疼痛皆可产生较好的效果,但长期服用会导致胃肠道的损伤[27]。这些抗炎镇痛药临床运用非常多,但也应该正视它们的毒副作用。因此,研究一种安全、毒副作用小的抗炎镇痛药物是十分有必要的。本研究首次证明了JYRF-CDs的抗炎镇痛活性,这使得了JYRF-CDs成为一种抗炎镇痛药物成为可能。与蛋白质相比,JYRF-CDs更稳定,更适合长期保存,因此在某些极端和恶劣的环境下,JYRF-CDs有可能成为替代治疗药物。另外,这种新型的纳米类成分的发现也为炭药物质基础研究提供了一种新思路和方法。
参考文献(略)
来 源: 赵玉升,侯婷婷,赵金莉,刘楚妤,李伟洋,孔 慧,赵 琰,屈会化.以机油为分散剂高温热解人发合成新型碳点及其生物效应研究 [J]. 中草药, 2020, 51(14):3663-3669.



相关阅读
-

赵玉升,侯婷婷,北京中医药大学中药学院;赵金莉,刘楚妤,李伟洋,孔 慧,赵 琰,北京中医药大学中医学院;屈会化,北京中医药大学中医药研究院...
-

11月中旬,能化181班开展了“增强法律知识,做合格大学生”主题活动...
-

大家好,我是安迪。在这里,我想分享一个发生在我身上的故事,它不仅改变了我的,还让我深刻体会到知识的力量。我的故事发生在几年前,那时我刚刚嫁入一个...
-

呼吸一定需要氧气吗?不一定,既然如此为何不呼吸氮气?,氮气,厌氧,微生物...
-

4月10日至13日,中共中央总书记、国家主席、中央军委主席习近平在广东考察。这是10日下午,习近平在湛江市徐闻县徐闻港泊位码头...
-

11月中旬,能化181班开展了“增强法律知识,做合格大学生”主题活动...
-

大家好,我是安迪。在这里,我想分享一个发生在我身上的故事,它不仅改变了我的,还让我深刻体会到知识的力量。我的故事发生在几年前,那时我刚刚嫁入一个...
-

呼吸一定需要氧气吗?不一定,既然如此为何不呼吸氮气?,氮气,厌氧,微生物...
-
欢迎来到四叶草堂,我是龙笑生。不同知识形式具有不同程度的反身性,主要包括这三类:直觉知识、实践知识和理论知识。更多精彩内容,敬请关注“四叶草堂”...
-

4月10日至13日,中共中央总书记、国家主席、中央军委主席习近平在广东考察。这是10日下午,习近平在湛江市徐闻县徐闻港泊位码头...
-
1哈尔滨工业大学攻读博士学位研究生导师考核和推荐意见表考生姓名身份证号报考学科0810信息与通信工程报考导师考核时间9月5日9时30分—11时30分考核地点哈尔滨成绩(满分.......
发表评论
版权声明:本文内容由互联网用户自发贡献,该文观点仅代表作者本人。本站仅提供信息存储空间服务,不拥有所有权,不承担相关法律责任如发现本站有涉嫌抄袭侵权/违法违规的内容,请发送邮件举报,一经查实,本站将立刻删除。

