高瓴抢筹!下一个黄金赛道崛起,“黑马”蓬勃生物凭什么?

在CRO的关键路口,继高位减持凯莱英之后,高瓴又抛出了一个重磅信号。
8月19日,“基因合成之王”金斯瑞宣布,高瓴拟以2.75亿美元入股旗下子公司蓬勃生物。这意味着,在双方达成合作预案3个月后,高瓴入股蓬勃生物的另一只靴子正式落地。
根据协议,这笔投资主要分为两个部分,其中,1.5亿美元用于收购蓬勃生物17.05%的股权,此外,高瓴还拥有总对价为1.25亿美元的认股权证,一旦行权完毕,其持股比例将增至20.68%。
三个月前,高瓴曾宣布集中入股“金斯瑞系”的3家公司,在这笔超过80亿港元的天价项目中,其对蓬勃生物的拟定投资金额为1.5亿美元,对比来看,这一次,高瓴的增持意味相当明显。
作为长期号称专注于结构性价值投资的私募巨头,高瓴在CXO领域,从 “小分子王者”凯莱英到 “大分子新秀”蓬勃生物,这一招一式都在给外界传递一种信息:髙瓴正在进一步拓充CXO领域的投资版图。
01 高瓴,押注一条黄金赛道
在投资界,“私募一哥”张磊引领下的高瓴,投资逻辑被外界形容为铺赛道式的生态布局,正因为如此,善于造风的高瓴一直被誉为资本市场的风向标。
从2014年入股百济神州开始,高瓴就将目光投向了医药行业,过去7年,“手眼通天”的张磊已经织就了一张医药大网,其中,囊括了海内外200多家公司,覆盖医药、器械、医疗等全产业链。
随着医药行业整体进入调整期,资本市场开始出现结构性分化,但正如张磊曾在其书中阐述的那样,成长是最好的安全边界,对于现阶段的高瓴来说,最具安全感的或许就是细胞基因治疗(GCT)。
2021年上半年,高瓴旗下有11家生物医药公司完成IPO,其中,科济医药、Century Therapeutics、Lyell Immunopharma、Talaris Therapeutics、Instil Bio等5家均来自于GCT这一赛道。
作为一种可以直接导入正常基因来修饰或改变遗传表达的新兴治疗方式,GCT对于很多无法找到成药靶点的疾病具有广泛的应用前景,被普遍认为是继单抗、双抗、ADC之后的下一代潜力赛道。
根据Drug Discovery Today数据,截至2020年7月,全球共开展了2106项GCT临床试验,其中,中国、美国、欧洲3大市场占据了半壁江山,如今,全球已经有19款GCT药物获批上市。
随着GCT赛道迅速走上风口,资本也开始疯狂涌入,2020年,中国共发生41起GCT融资交易,涉及的资金高达24亿美元,事实上,其中大部分资金都流向了技术更为成熟的CAR-T领域。
截至目前,在全球上市的CAR-T总共有5款,其中,高瓴投资的药明康德通过与巨诺合作,引入了后者旗下的Breyanzi,如若获批,其将成为继复星之后第二款在中国获批的CAR-T产品。
2021年5月14日,高瓴对金斯瑞系的80亿港元资产包中,有38.8亿港元流向了传奇生物,后者正是中国首个实现CAR-T自研的玩家,并且,其开发的这款产品甚至业内人士认为有望成为Best-in-Class。
在此之前,高瓴领投了北恒生物5.2亿元B轮融资,其通用型CAR-T产品CTD401获得美国FDA孤儿药资格认定,可以用于治疗T细胞急性淋巴细胞白血病,这是一款抗CD7通用型CAR-T。
此外,高瓴在医药领域的种子选手,百济神州也已经豪掷23亿美元,与吉利德旗下的两家公司Kite与Shoreline Biosciences达成战略合作,开发靶向NK细胞疗法和巨噬细胞疗法的产品。
毫无疑问,高瓴已经是中国CAR-T领域最资深的玩家之一,但CAR-T的问题在于,现阶段其临床疗效主要体现在血液瘤方面,对于实体瘤的效果并不明显,吊死在一棵树上显然不是张磊的风格。
事实上,在整个GCT领域,高瓴在早已开始全面下注。截至6月末,高瓴在二级市场上共持有40家医药股,其中,除了CAR-T之外,旗下公司已经覆盖TCR-T、TIL、NK细胞等多种细胞疗法。
与此同时,继小分子CDMO凯莱英之后,GCT CDMO作为第二代卖铲人,再次成为高瓴关注的焦点。
本质上,GCT CDMO与小分子CDMO的逻辑没什么区别,甚至GCT企业对于CDMO的依赖度还更高,根据CRB报告,GCT企业的外包率高达77%,这意味着GCT CDMO是一个更加诱人的黄金赛道。
在中国GCT CDMO市场的16个主要选手中,除了行业龙头药明生基,高瓴还投资了博腾生物、澳斯康生物等头部企业,再加上这次A轮融资进入的蓬勃生物,高瓴几乎拿下了大半市场份额。
其中,博腾生物与药明生基一样,均是从传统CRO切入GCT赛道,为了实现转型,博腾生物还砸重金拉来了全球首个基因疗法Glybera的缔造者Sander van Deventer担任首席科学家。
作为国内少有的整合性CMC组织,澳斯康生物手握100多个重磅客户,还在3年内斩获了4轮融资,累计融资金额超过11.5亿元,最近的一次融资金额高达4亿元,由高瓴和国风基金领投。
高瓴在GCT赛道所投的10余家公司中,金斯瑞的特别之处在于,其是继药明康德之后,唯一一个横跨CGT和CDMO两大领域的玩家,某种程度上,其在GCT产业链上的布局比药明系更加完整。
02 “等风者”金斯瑞
作为GCT领域的一方霸主,金斯瑞是中国CRO市场最早的玩家之一,至今已经走过19个春秋。
2002年,章方良离开工作7年的先灵葆雅,与同事王鲁泉一起,在新泽西当地成立了金斯瑞。此后,初到美国的王烨也加入进来,金斯瑞的创始团队最终成型,那一年,章方良38岁。
在此之前,他曾执教于华中科技大学,后辗转海外求学,拿到了杜克大学生物化学博士学位,当时,已经是先灵葆雅的联合首席科学家,并在全球范围内首次成功克隆人类geranyl转移酶。
当时,药明康德在李革的带领下,已经提前出发,身在大洋彼岸的章方良却觉得,“中国CRO市场上,做化学CRO很热闹,而生物CRO却很弱”,所以,金斯瑞一开始就选择从生物领域切入。
最初,金斯瑞采取的是在美国接单、给国内供货的模式,短短半年就赚了几十万美元。但很快,章方良发现这种模式无法适应业务的发展,于是带着团队回到国内,在曾经读书的南京扎下根来。
很长一段时间,金斯瑞就在双拜巷一间不足20平米的小实验室里默默拓荒,但正如章方良所言,创业不是一个讲情怀的事情,其实很多时候是绝处逢生,就是有这种压力,才会有创新的动力。
如果说差异化的市场定位是金斯瑞在商业模式上的突破,那么,金斯瑞在研发模式上的“工业化”变革,则撬动了平台进阶的核心,毕竟,最终决定一家CRO公司市场竞争力的还是成本和效率。
不同于药明康德初期根据不同的研发项目,将其分成“默克组”、“辉瑞组”等等,金斯瑞是将研发流程进行“工业化”拆解,按照“基因”、“蛋白”分组研发、优化,最终再将其进行整合。
某种程度上,这是一条更适合生物大分子的产业链,毕竟,基因合成的需求更加零散且个性化。在这种被称为“实验室工厂”的模式下,研发可以快速规模化,金斯瑞当时的价格比同行低30%。
长期来看,这种规模效应更加明显。当时,每个碱基的价格是几美元,合成一条基因需要几万美元,如今,却低至几百美元,每个碱基甚至只要零点几美元,并且,一周左右就可以交付。
凭借这种服务模式,金斯瑞很快就打开了市场,业绩增速连续多年保持在50%以上,并且将默克、罗氏等全球排名前20的药企几乎都一网打尽,2008年,金斯瑞已稳坐全球基因合成第一把交椅。
2009年6月,金斯瑞获得KPCB和贝祥医疗基金的1500万美元融资。作为章方良的校友,KPCB合伙人钟晓林是最早捕捉到金斯瑞潜质的投资人,在他看来,金斯瑞可以做成第二个基因泰克。
在资本的加持下,金斯瑞开始向着生物科技研发平台进发,2013年,金斯瑞成立百斯杰,涉足工业酶,2014年,金斯瑞切入生物制药和CDMO领域,并孵化出了后来的传奇生物和蓬勃生物。
当时,整个生物制药领域,做CAR-T的不超过20家,临床项目在10个左右,金斯瑞却坚定杀入,并决定由海归科学家范晓虎亲自带队。事实上,这份坚定背后,还有一个悲伤的故事。
2013年4月,章方良的父亲被确诊为胃癌,当时,默克正在美国做PD-1的临床试验,章方良非常希望得到这个机会,通过最新的生物技术挽救父亲一命,但因为种种限制,最终未能如愿。
金斯瑞的生物制药由此开始加速,很快,细胞及基因治疗的风口也来了。2017年,在芝加哥召开的ASCO大会上,传奇生物凭借在35位患者身上的100%临床缓释率,在CAR-T界一战成名。
这项突破不仅为金斯瑞斩获了中国首个CAR-T临床批文,还获得了全球8家顶尖药企的哄抢,最终,强生杨森以3.5亿美元的首付款拿下这笔合作,双方携手在全球共同开发Cilta-cel。
2020年6月,传奇生物顶着“中国CAR-T第一股”的光环,独立分拆上市,成为继2015年金斯瑞上市之后,金斯瑞系孵化的第二家上市公司,至此,金斯瑞的GCT产业链也正式浮出水面。
凭借19年的继续耕耘,金斯瑞以基因合成作为底层支撑,构建了一个横跨生命科学服务及产品业务、生物药CDMO、细胞治疗业务的GCT产业链,其中,蓬勃生物更是以黑马之姿冲了出来。
03 蓬勃生物:GCT赛道的一匹黑马
作为金斯瑞旗下的CDMO公司,蓬勃生物与传奇生物同时起步,最初只是生物药的一个事业部,团队规模也不过几十人,2018年前后,开始拓展细胞基因业务,2020年,正式推出独立品牌。
“ProBio”,即,蓬勃生物,现阶段主要涵盖两大业务线:抗体药物开发和细胞基因治疗。
其中,抗体药物服务,源自金斯瑞2004年开始建立的工艺开发能力,提供从靶点到IND的一体化抗体药CDMO服务,拥有抗体药物研发实验室和符合GMP标准的中试生产车间,总产能达2600L。
在细胞基因治疗方面,提供包括质粒、慢病毒载体和AAV的从临床前研究,IND申报,临床试验阶段到商业化的一站式服务,具有丰富的质粒生产和工艺经验,是中国最大的质粒CDMO供应商。
华安证券研报显示,在中国生物CDMO市场中,蓬勃生物的整体份额为3.2%,位列行业第四。
但依托金斯瑞的积累,蓬勃生物的CDMO业务进展迅猛,2020年其在手订单达到9500万美元。
其中,在抗体药物服务方面,蓬勃生物2020年新增185个抗体发现项目,14个CMC或临床生产项目,2个双特异性抗体技术平台共同开发项目,并且,对外授权了5种候选抗体药物。
细胞基因治疗方面,全年新增了29个临床前阶段项目,14个CMC项目和14个临床阶段项目。
相较而言,细胞基因增长更为强劲。根据金斯瑞最新的财报,2021年H1,蓬勃生物总营收为3150万美元,同比增长65.8%,其中,抗体药物收入同比增长58.3%,细胞基因治疗收入同比暴涨253%。
对此,金斯瑞轮值首席执行官柳振宇在业绩发布上表示,接下来几年,金斯瑞将紧跟行业趋势,加速对基因和细胞治疗产业链的战略投入,以满足我们的客户对这一革命性行业的强劲需求。
2017年以来,随着Kymriah、Luxturna、Zolgensma等产品相继获批,细胞基因治疗迅速走上风口。但受制于技术机制、工艺和产业化等诸多因素,相较于小分子,这个领域的CDMO门槛更高。
总体来说,现阶段细胞基因治疗领域的CDMO最核心的服务有三类:质粒、病毒载体、细胞工厂。其中,蓬勃生物主要聚焦于质粒和病毒载体,二者均是细胞基因治疗药物生产工艺中的核心环节。
所谓质粒,其实就是独立于宿主染色体可以进行自主复制的核酸分子,是绝大部分细胞基因治疗产品的起始物料,既可以作为载体直接用于治疗,也可以用于生产病毒载体或者mRNA疫苗模板。
新冠疫情爆发以来,蓬勃生物迅速切入mRNA疫苗市场,2019年投产的5000平GMP质粒病毒车间,具备临床I/II期样本生产能力,拥有多条质粒生产线,可以同时进行20多个项目的开发。
此外,蓬勃生物仍然在不断扩大产能,蓬勃生物CEO Brian Min对E药经理人表示,其在镇江的第二栋质粒CMP生产车间也将在今年投产,届时,公司的质粒产能将扩大到现在的两倍。
2020年,蓬勃生物全年新增57个GCT项目,囊括众多mRNA疫苗研发企业,其中,中国几乎所有的mRNA疫苗企业,比如,艾博生物、丽凡达生物、斯微生物等,质粒生产均由蓬勃生物提供。
今年上半年,蓬勃生物在GCTCDMO领域继续领跑,新增3个mRNA疫苗IND临床批件。截至目前,公司有50多个IND申报用质粒CMC项目在推进,并有超过50个临床用GMP质粒生产批次。
相较于质粒,在细胞基因治疗中,病毒载体是一个更大的市场,其高昂的成本和规模化难题,是现阶段整个行业的核心瓶颈,临床中,使用最多的AAV占比超过40%,其次是慢病毒载体在30.7%。
作为中国首个慢病毒载体CDMO及领先的AAV供应商,蓬勃生物可以提供早期临床阶段的慢病毒产能以及IND及前阶段的腺病毒产能,在生产上,蓬勃生物也建立了自主开发的悬浮培养体系。
2019年3月,金斯瑞与默克在细胞基因领域达成全面战略合作,此后,默克在质粒病毒生产方面为金斯瑞提供从产品、工艺、厂房设计、质量体系和GMP合规人员培训等360度全方位服务。
默克的加持无疑极大地提升了蓬勃生物的服务能力,尤其在质量体系上,建立了横跨FDA和NMPA的通道,此外,蓬勃生物CEOBrian Min博士透露,公司正在努力打通日本市场的质量体系。
2021年2月,蓬勃生物上线了最新的腺病毒载体生产服务,进一步完善CDMO链条。
此前,在蓬勃生物与香雪的整体合作方案中,除了涉及针对实体瘤的TCR-T治疗方案TAEST16001注射液的临床申报、临床级和GMP级质粒,其实也涵盖了慢病毒载体的工艺开发和生产服务。
但总体来说,相较于药明生物、赛诺生、和元生物等玩家来说,蓬勃生物在病毒载体这个领域,其实并不占优势,并且,所有玩家都在跑马圈地,这个资源密集型的领域,竞争正日益白热化。
对此,Brian表示公司也做好了准备,随着高瓴的介入,蓬勃生物有更多能力去进行扩张,未来也会考虑使用长期租赁车间、收购兼并等多种方式,参与到GCT的下一个大时代中。



相关阅读
-

E药经理人...
-

......
-

“生物节律紊乱体细胞克隆猴模型”重大成果发布和神经所-药物所战略合作协议签署仪式
中国科学院脑科学与智能技术卓越创新中心,神经科学研究所,中国科学院...
-

现在的亚洲第一科技强国还是日本吗?世界十大科技强国都是谁、都有哪些厉害之处?一、中国。中国当今科技拥有全球无敌的十项逆天工程及大型制造。这些工程在世界上具有很大影响力...
-
你有没有被亲戚朋友这样灵魂拷问过:你大学读的什么专业啊,毕业后干什么工作啊......然后发现自己竟然答不上来,只得敷衍过去。是啊!我们所学专业...
-

......
-

你有没有被亲戚朋友这样灵魂拷问过:你大学读的什么专业啊,毕业后干什么工作啊......然后发现自己竟然答不上来,只得敷衍过去。是啊!我们所学专业...
-

1032年,李宸妃病逝,太后刘娥准备秘密以宫人之礼下葬。宰相吕夷简听说连忙入宫:“太后要不想日后刘家满门抄斩,此事需慎重!”...
-

中国移动中期业绩:移动云收入达到504亿元,同比增长19.3%
【产业互联网周报】移动云收入达到504亿元,同比增长19.3%;字节被曝寻求50亿美元贷款再融资;英特尔裁员1.5万人中国成重灾区,融资,微软,英特尔,阿里云,云计算,移动云......
-
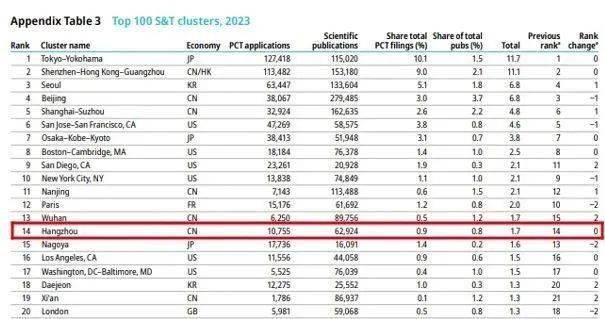
报告显示,杭州在全球科技集群中保持第14位排名,连续两年进入世界前15行列,同时首次进入全球科技强度排名前30强,中国排名第3位,位于北京、南京之后。 报告显示...
-
【人民日报】中国科研团队成功构建首批生物节律紊乱体细胞克隆猴模型
“失眠”猴研究节律紊乱的理想动物模型雄鸡报晓、蜘蛛半夜结网、向日葵在清晨开放……自然界中的生物大都拥有按时间节奏调节自身活动的本领,我们称之为生物节律,也就是通常所说的生物钟......
发表评论
版权声明:本文内容由互联网用户自发贡献,该文观点仅代表作者本人。本站仅提供信息存储空间服务,不拥有所有权,不承担相关法律责任如发现本站有涉嫌抄袭侵权/违法违规的内容,请发送邮件举报,一经查实,本站将立刻删除。

